Modelos Atômicos: Evolução da Teoria Atômica Explicada
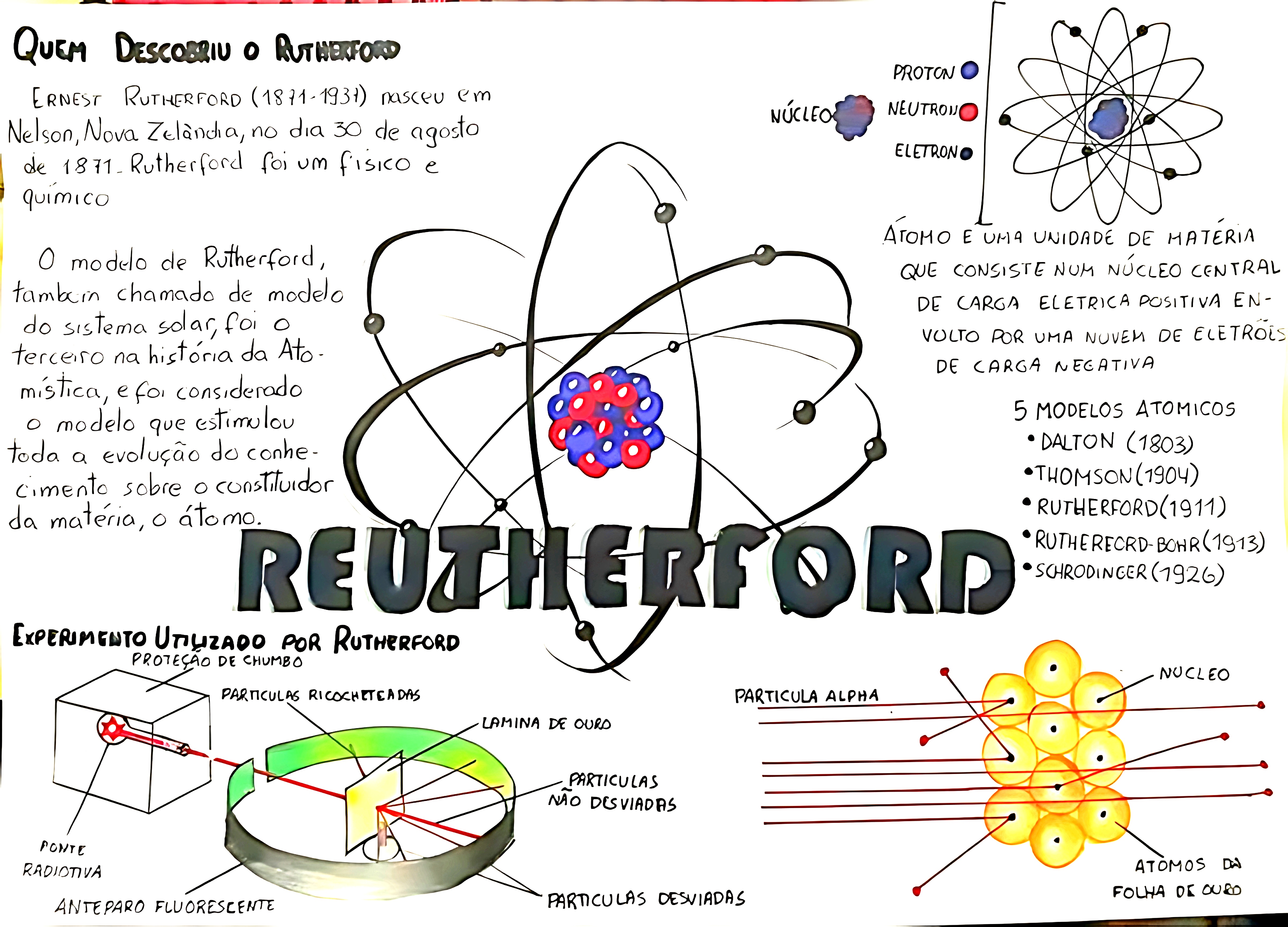
📌 O que são os Modelos Atômicos?
Os modelos atômicos representam a evolução do conhecimento humano sobre a estrutura da matéria. Desde a filosofia grega até a física quântica moderna, várias teorias foram desenvolvidas para explicar a composição dos átomos, suas partículas subatômicas e como elas interagem.
🔬 Principais Modelos Atômicos Estudados
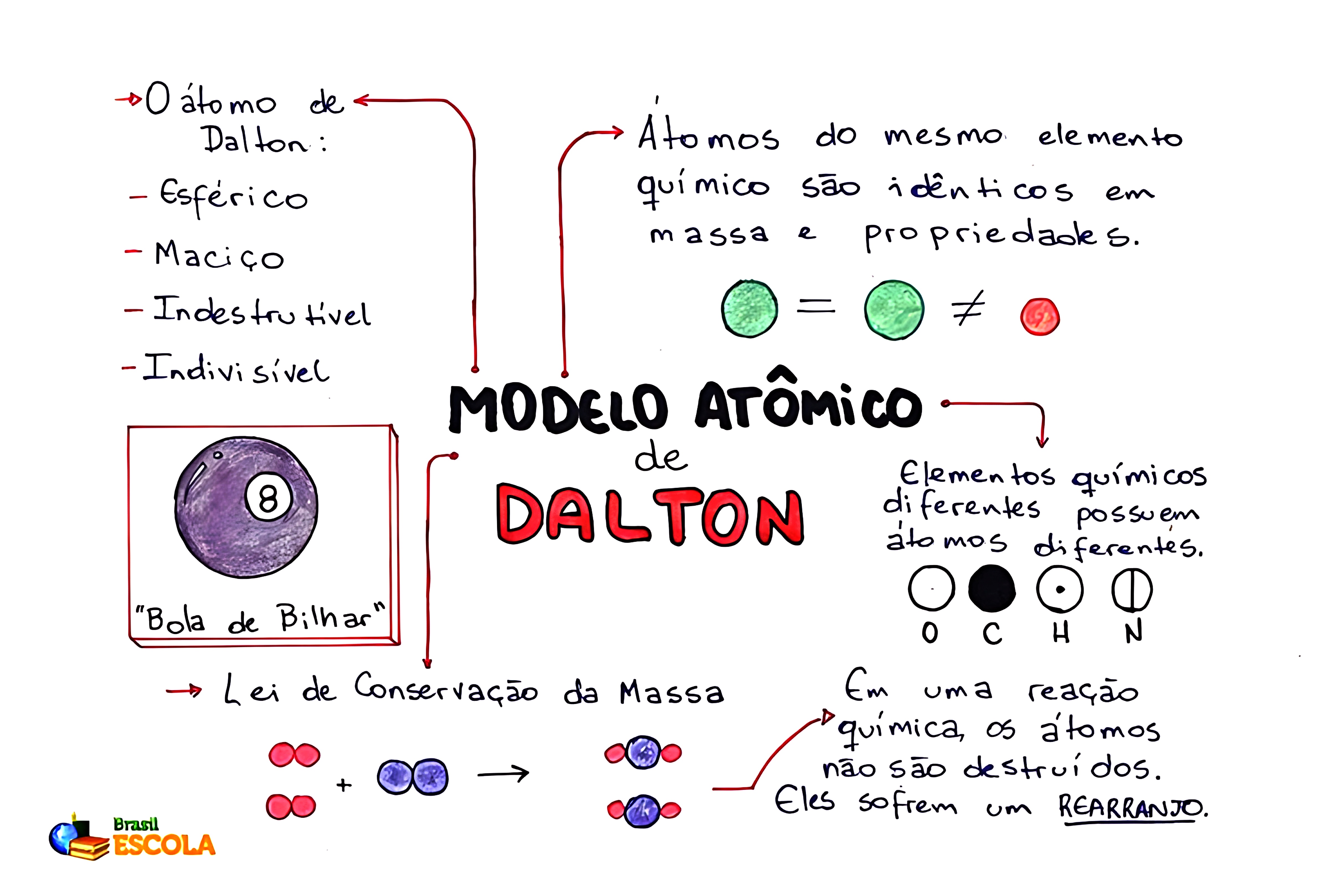
✔ Modelo de Dalton (1803) – Átomo como esfera maciça e indivisível.
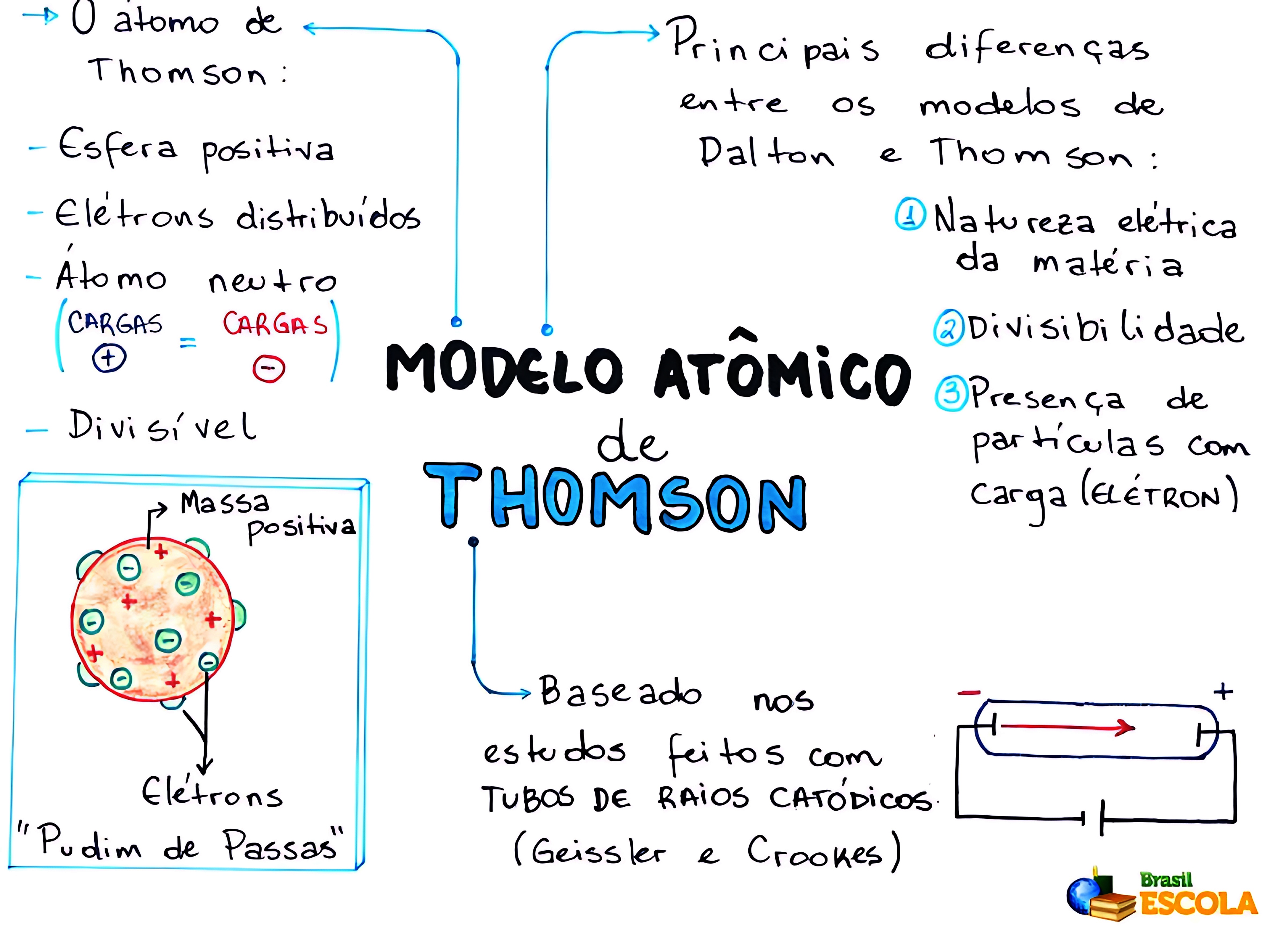
✔ Modelo de Thomson (1897) – Átomo como uma esfera positiva com elétrons distribuídos (Pudim de Passas).
✔ Modelo de Rutherford (1911) – Núcleo pequeno e denso, com elétrons ao redor.
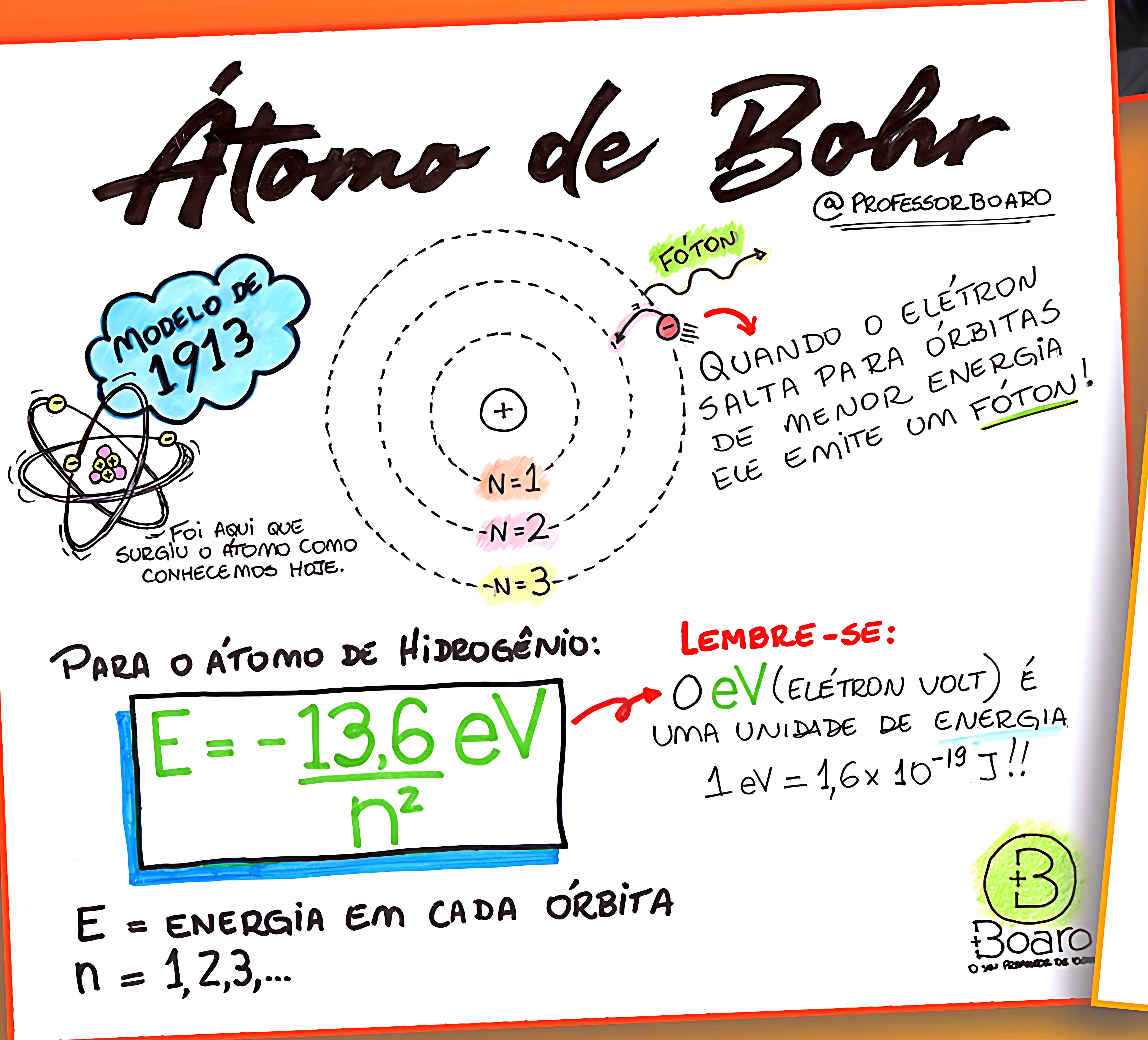
✔ Modelo de Bohr (1913) – Elétrons em camadas de energia fixas.
✔ Modelo Quântico Atual – Nuvens eletrônicas baseadas na probabilidade.
Cada um desses modelos trouxe novas descobertas que ajudaram a formar a compreensão atual do átomo. Vamos analisar detalhadamente cada um deles!
⚛️ 1. Modelo Atômico de Dalton (1803) – A Teoria Atômica Clássica
📌 Principais características:
✅ O átomo é uma esfera maciça, indivisível e indestrutível.
✅ Cada elemento químico tem átomos com massa e propriedades fixas.
✅ Compostos químicos são formados por combinações de átomos em proporções definidas.
📌 Limitações do modelo:
❌ Não explicava a existência de partículas subatômicas.
❌ Não considerava a carga elétrica dos átomos.
⚛️ 2. Modelo Atômico de Thomson (1897) – Pudim de Passas
📌 Principais características:
✅ O átomo é uma esfera positiva com elétrons negativos embutidos.
✅ Os elétrons foram descobertos nos raios catódicos.
✅ Esse modelo propunha uma distribuição homogênea de carga.
📌 Limitações do modelo:
❌ Não explicava a existência do núcleo atômico.
❌ Sugeriu uma distribuição homogênea da carga positiva, o que não condiz com a realidade.
⚛️ 3. Modelo Atômico de Rutherford (1911) – O Modelo Nuclear
📌 Principais características:
✅ O átomo tem um núcleo pequeno, denso e carregado positivamente.
✅ Os elétrons orbitam ao redor do núcleo.
✅ O experimento da Folha de Ouro provou que o átomo é majoritariamente vazio.
📌 Limitações do modelo:
❌ Não explicava por que os elétrons não colapsam no núcleo.
❌ Não determinava níveis de energia para os elétrons.

⚛️ 4. Modelo Atômico de Bohr (1913) – Níveis de Energia
📌 Principais características:
✅ Os elétrons giram em órbitas fixas ao redor do núcleo, chamadas de camadas eletrônicas.
✅ Quando um elétron absorve energia, ele pode saltar para uma órbita mais externa.
✅ Ao retornar, libera energia na forma de luz (fótons).
📌 Limitações do modelo:
❌ Não explicava a dualidade onda-partícula dos elétrons.
❌ Funciona bem para o hidrogênio, mas não para átomos mais complexos.
⚛️ 5. Modelo Quântico Atual – Orbitais Eletrônicos
📌 Principais características:
✅ Os elétrons não seguem órbitas fixas, mas sim regiões de probabilidade chamadas de orbitais.
✅ O Princípio da Incerteza de Heisenberg diz que não podemos determinar ao mesmo tempo a posição e a velocidade do elétron.
✅ O comportamento dos elétrons é descrito por funções de onda na Mecânica Quântica.
📌 Vantagens do modelo quântico:
✔ Explica ligações químicas, condutividade elétrica e espectros atômicos.
✔ Modelo mais aceito atualmente na Física e Química Moderna.

🛠️ Comparação dos Modelos Atômicos
| Modelo | Principais Características | Limitações |
|---|---|---|
| Dalton | Átomo como esfera indivisível | Não explicava partículas subatômicas |
| Thomson | Descoberta dos elétrons | Não explicava o núcleo atômico |
| Rutherford | Núcleo pequeno e denso | Não explicava a estabilidade dos elétrons |
| Bohr | Introduziu níveis de energia | Não considerava a dualidade onda-partícula |
| Quântico | Orbitais e comportamento probabilístico | Modelo mais aceito atualmente |
📖 Conclusão
Os modelos atômicos evoluíram ao longo do tempo conforme novas descobertas foram feitas. Atualmente, o Modelo Quântico é o mais aceito, explicando com precisão as interações atômicas.
O estudo dos átomos é essencial para entender desde reações químicas até a física dos semicondutores, impactando áreas como nanotecnologia e computação quântica.







